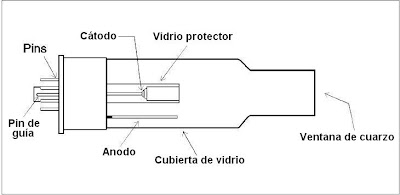
El funcionamiento de un espectrómetro de absorción atómica puede implicar el uso de gases comprimidos, llamas y materiales peligrosos, incluyendo fluidos corrosivos y líquidos inflamables. El uso por personal no calificado, uso impropio o descuidado de este instrumento puede crear riesgos de explosión, incendio u otros peligros que pueden causar la muerte, lesiones graves a personal, o daños graves al equipo y propiedades.
Calor y gases ácidos y tóxicos
El calor, vapores y humos generados por la llama es peligroso para el personal, debe ser extraído del instrumento por un el sistema de extracción de gases. Localizar la salida del sistema de tal manera que el escape no puede volver a entrar en el edificio a través de cualquier puerta, ventana, entrada de aire acondicionado, ventilador, etc. Construir el sistema de acuerdo con los códigos y reglamentos para la ventilación. El sistema de extracción de gases debe ser capaz de proporcionar una tasa de ventilación de al menos 6 metros cúbicos por minuto (200 pies cúbicos por minuto).
Gases comprimidos
Todos los gases comprimidos (excepto aire) pueden crear un peligro si se filtran a la atmósfera. Incluso las pequeñas fugas en los sistemas de suministro de gas puede ser peligroso. Cualquier fuga (excepto la del aire) puede provocar una explosión, un peligro de incendio, o dar lugar a una atmósfera deficiente en oxígeno. Tales riesgos pueden causar la muerte, lesiones graves, asfixia, efectos anestésicos y/o daños graves al equipo y materiales. Los cilindros deben ser almacenados y manipulados en estricta conformidad con las regulaciones y códigos de seguridad. Los cilindros deben ser utilizados y almacenados sólo en una posición vertical. Asegure todos los cilindros a una estructura o un soporte adecuadamente construido. La zona en la que encuentren almacenados los cilindros deben estar bien ventiladas para evitar acumulaciones tóxicas o explosivas. Mantenga fríos los cilindros. Esta regla se aplica a cada cilindro de gas comprimido. Los cilindros tienen dispositivos de alivio de presión que liberan el contenido del cilindro si la temperatura supera los 52 °C. Asegúrese siempre de que se tenga el cilindro correcto antes de conectar el cilindro al instrumento.
Al suministrar aire desde un compresor, toda la humedad debe ser extraída desde el aire antes de que se suministre al módulo de control de gas, la humedad puede afectar a los componentes internos del sistema de control de gases y crear una situación potencialmente peligrosa. Utilice sólo los reguladores aprobados y conectores de manguera. Recuerde que para las conexiones del cilindro, los accesorios de rosca izquierda se utilizan para combustible; accesorios de rosca a la derecha se utilizan para los gases de apoyo Al final de la jornada de trabajo, asegúrese siempre de cerrar las válvulas de los cilindros de gases.
Al suministrar aire desde un compresor, toda la humedad debe ser extraída desde el aire antes de que se suministre al módulo de control de gas, la humedad puede afectar a los componentes internos del sistema de control de gases y crear una situación potencialmente peligrosa. Utilice sólo los reguladores aprobados y conectores de manguera. Recuerde que para las conexiones del cilindro, los accesorios de rosca izquierda se utilizan para combustible; accesorios de rosca a la derecha se utilizan para los gases de apoyo Al final de la jornada de trabajo, asegúrese siempre de cerrar las válvulas de los cilindros de gases.